近日,兰州大学功能有机分子化学国家重点实验室阳铭教授课题组完成了木藜芦烷二萜天然产物Principinol B的首次不对称全合成。相关成果近期在线发表在国际知名期刊Angew. Chem. Int. Ed.(DOI: 10.1002/anie.202400956)上。
木藜芦烷二萜广泛分布于杜鹃花科植物中。迄今为止,已有超过300个木藜芦烷二萜天然产物被分离鉴定出来。这类分子具有丰富的生物活性,如调节钠离子通道、止痛、镇静、杀虫和拒食等活性。从结构上看,大多数木藜芦烷二萜拥有独特的5/7/6/5四环碳骨架,内含7-10个手性中心以及密集排布的羟基。其复杂的骨架结构和潜在的重要生物活性吸引了国内外合成化学家和药物化学家的广泛关注。
天然产物(+)-Principinol B是复旦大学侯爱君团队于2014年从中国藏南杜鹃地上植株部分分离得到的一种木藜芦烷二萜天然产物。该天然产物具有独特而新颖的5/5/6/6/5五环骨架,其中包括一个全碳[3.2.1]桥环结构、一个氧杂[3.2.1]桥环结构和8个连续的手性中心。Principinol B中C5位的立体构型与经典的木藜芦烷二萜相反。虽然该课题组最近在具有相似结构的Rhodomollins A和B的首次不对称全合成中(J. Am. Chem. Soc. 2023, 145, 27160.)通过在A环片段中预先引入相应的手性中心来构筑C5位的立体构型,但是其C1位的手性中心则需要通过多步转化来引入。而本文报道的合成路线则可以通过直接并且高效的方式引入C1和C5手性中心,并通过羰基/烯烃复分解反应构建关键的七元环来实现Principinol B的首次不对称全合成。
Principinol B的逆合成分析如图一所示,由于受Rhodomollins A and B合成的启发,作者认为Principinol B的氧杂[3.2.1]桥环可以由化合物2通过Williamson 醚合成得到,化合物2中C5,C6双羟基可以由化合物3通过双羟化得到,其立体构型由C1位构型所决定,化合物3可以通过羰基/烯烃复分解反应由化合物4制备,化合物4可以通过已知五元环模块5和桥环模块6通过分子间Aldol反应制备,桥环模块6可以由化合物7通过自由基环化由得到,化合物7可以由化合物8通过Tamao-Fleming 氧化反应及串联的酯交换反应得到,化合物8可以由化合物9通过相应官能团转化得到。
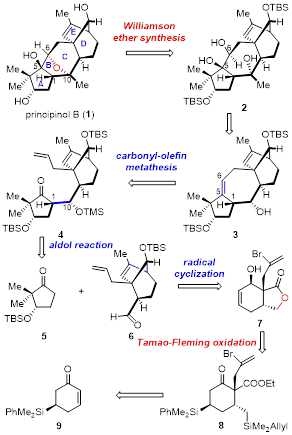
图一 Principinol B的逆合成分析
该路线从桥环模块6的合成开始(图二)。作者首先从化合物9出发。该化合物可以通过商业可得的环己烯酮通过催化对映选择性硅基的1,4加成和Mukaiyama脱氢两步反应制备。化合物9通过烷基铜试剂的1,4加成紧接着氰基甲酸乙酯捕获得到β-酮酸酯中间体,然后在NaH的作用下引入乙烯基溴侧链得到化合物8,接下来,通过一个两步的Tamao-Fleming氧化反应制备化合物11,首先在HBF4•Et2O作用下选择性脱除硅基上的烯丙基侧链,然后在氟化钾、碳酸氢钠和过氧化氢的条件下,将硅基氧化为一级羟基,同时在该条件下,立即发生分子内酯交换反应得到化合物11。接下来为了探究自由基环化的可行性,化合物11首先在氧化剂氯化铜作用下对苯基二甲基硅基氧化消除获得烯酮,再通过Luche还原烯酮得到环化前体化合物7。值得一提的是,在此设计中,虽然手性硅基在自由基环化反应之前被消除,但是其在整个合成过程中起到了立体控制作用。作者顺利利用化合物7在n-Bu3SnH, AIBN条件下得到自由基环化产物,接着向反应体系中加入TfOH,部分环外双键在酸性条件下发生异构化得到环内双键,以两步一锅法分别以20%和31%的收率获得环外双键化合物12及环内双键化合物13。环外双键化合物12可以在同样条件下以60%的产率以及71%的回收率转化为化合物13。作者利用TBS保护化合物13中的羟基,然后向反应体系中加入DIBAL-H,通过一锅法选择性的将内酯还原成半缩醛得到化合物14。化合物14在乙烯基溴化镁的作用下,将半缩醛打开,紧接着乙烯基溴化镁对醛加成得到双羟基化合物,其在Ac2O淬灭的条件下得到双醋酸酯化合物。随后,烯丙基醋酸酯在钯催化还原条件下脱除得到烯丙基化合物,反应完后通过向反应体系中加入甲醇和甲醇钠一锅法脱除另一个醋酸酯得到羟基化合物15,该化合物通过Parikh–Doering氧化得到桥环模块6。
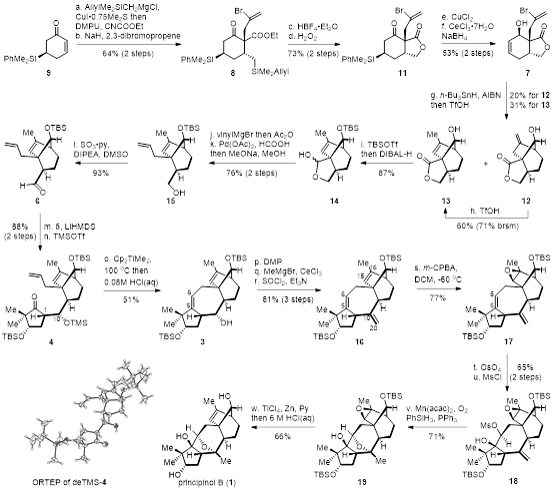
图二 Principinol B的不对称全合成
接下来,作者将注意力放在天然产物四元碳骨架的构建上。五元环模块5与桥环模块6通过分子间立体选择性的Aldol反应以及二级羟基的TMS保护得到化合物4。其中Aldol产物deTMS-4的立体构型通过单晶衍射证实。作者开始探索羰基/烯烃复分解反应来构筑七元碳环。令人高兴的是,化合物4与Petasis试剂在90 ℃的条件下得到了少量想要的环化产物,通过后续的研究发现,新制备的Petasis试剂在甲苯中升温至100 ℃时效果最佳,随后加入1 M HCl水溶液一锅法脱除TMS保护基得到化合物3。值得一提的是,虽然Tebbe试剂可以产生与Petasis试剂相同的中间体,但是在该反应中Tebbe试剂只是导致了底物的分解并没有生成所要的产物,这可能是由于Tebbe试剂具有较强的路易斯酸性,并且化合物4对酸比较敏感所致。
考虑到Petasis试剂既是烯基化试剂,也是烯烃复分解反应的催化剂,该反应也可能是羰基烯基化/烯烃复分解关环(RCM)串联反应。因此作者通过化合物20和化合物22的相应的控制反应,对该反应的具体机理进行了研究(图三)。化合物20在相同的环化条件下(Petasis试剂,甲苯,100 ℃)以24%的产率得到亚甲基化产物21,其产率远低于环化产率51%。同时,化合物22在相同条件下,并没由环化产物生成,并且原料完全分解。化合物22在Grubbs催化剂的条件下也未进行烯烃复分解关环(RCM)反应。因此,作者证明了该反应不是一个羰基烯基化/烯烃复分解关环(RCM)串联反应过程,而是由Petasis试剂衍生的钛卡宾的[2+2]环加成到末端烯烃,然后在逆[2+2]环加成步骤中释放出乙烯气体同时产生新的钛卡宾,其再与酮羰基发生第二次[2+2]环加成,最后逆[2+2]环加成得到环化产物和Cp2Ti=O的羰基/烯烃复分解关环反应过程。
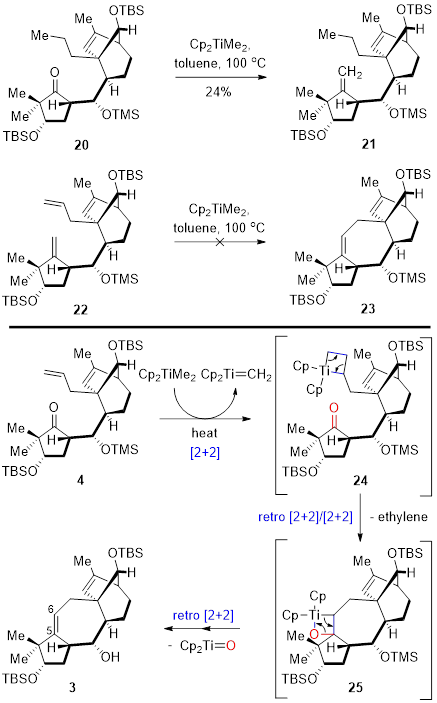
图三 羰基/烯烃复分解反应的控制反应以及机理研究
随后,化合物3通过DMP氧化、甲基铈试剂加成、三级羟基消除三步得到化合物16。遗憾的是,作者试图在C5=C6双键处选择性双羟化但并没有成功,研究发现C15=C16双键在三个双键中活性最高,因此,决定首先用环氧将C15=C16双键保护,后期再重新释放出来,化合物16先在m-CPBA作用下对活性最高的双键进行立体选择性环氧化,然后用OsO4对C5=C6双键进行非对映选择性双羟基化,紧接着在二级羟基上选择性上甲磺酸酯(Ms)得到化合物18。为了构建氧杂[3.2.1]桥环结构,作者决定先在C10位引入羟基,令人意外的是,化合物18在Mukaiyama水合的条件下并没有得到三级羟基化合物而是直接得到环化产物19,这可能是由于在该底物中新形成的三级羟基可以自发进行Williamson醚合成反应。
最后,作者需要将环氧还原为烯烃来实现Principinol B的合成。作者首先尝试了Cp2TiCl2和锌粉原位制备的三价钛Cp2TiCl来还原化合物19中的环氧。不幸的是作者只得到烯丙醇化合物而并未监测到烯烃化合物的产生。这有可能是因为桥环体系的位阻较大,阻碍了体积较大的Cp2TiCl捕获开环氧后形成的碳自由基,进而阻碍了Ti-O的消除。为了克服该影响,作者决定使用TiCl4和锌粉原位制备位阻更小的低价钛来还原环氧。令人高兴的是在该条件下,有少量环氧还原成烯烃的产物产生。当在反应中加入吡啶时,烯烃收率明显提高,随后加入6.0 M盐酸水溶液一锅法脱除TBS保护基则可以得到天然产物Principinol B。
作者还尝试了利用其他方法来构建Principinol B中氧杂[3.2.1]桥环结构(图四)。化合物16在m-CPBA的作用下对C5=C6, C15=C16双键进行立体选择性环氧化得到双环氧化合物26,并且其结构通过单晶衍射得到确认。化合物26通过Mukaiyama水合反应引入C10位的氧化态得到化合物27。由于化合物27非常不稳定的,作者尝试了各种条件,均未实现三级羟基开环氧合成氧杂[3.2.1]桥环结构。
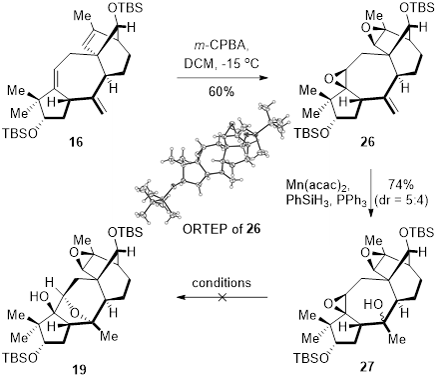
图四 构建氧杂[3.2.1]桥环的其他尝试
综上所述,阳铭教授课题组通过立体选择性的1,4加成反应、Tamao-Fleming氧化反应、自由基环化反应构筑了全碳[3.2.1]桥环模块,接着通过分子间立体选择性的Aldol反应连接五元环模块,利用羰基/烯烃复分解反应,Williamson醚合成以及大位阻环氧的还原等关键反应,实现了木藜芦烷二萜天然产物Principinol B的首次不对称合成。该合成两次利用了硅基取代基,一次利用可消除的硅取代手性中心引入全碳[3.2.1]桥环模块的原始手性,一次利用硅取代甲基亲核试剂引入羟甲基。
该论文的第一作者为我校博士研究生杜强,硕士研究生范志博也做出了重要贡献。该工作受到国家自然科学基金优秀青年基金和面上项目、甘肃省科技重大专项、中央高校基本科研业务费和功能有机分子化学国家重点实验室的大力资助。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202400956